Pozytonowa tomografia emisyjna (ang. positron emission tomography, PET) jest najbardziej zaawansowaną techniką obrazowania stosowaną obecnie w medycynie. Wywodzi się ze scyntygrafii, w której do organizmu pacjenta wprowadzany jest preparat zawierający izotop radioaktywny, a następnie detektor bada jego rozmieszczenie w diagnozowanej tkance. W tym celu najczęściej wykorzystuje się izotopy emitujące promieniowanie gamma, np. jod-131 przy scyntygrafii tarczycy [LINK]. Z kolei w pozytonowej tomografii emisyjnej stosuje się izotopy ulegające rozpadowi beta plus. W tym rozpadzie jeden z protonów ulega przemianie w neutron z jednoczesną emisją neutrina i pozytonu. Liczba atomowa pierwiastka zmniejsza się o 1, czyli cofa się on o jedno miejsce w układzie okresowym. Liczba masowa pozostaje bez zmian, zatem powstały pierwiastek jest tzw. izobarem pierwiastka, z którego powstał. Poniżej porównanie rozpadu beta minus, który omawiałem niedawno [LINK] i beta plus (na dole)
Pozyton jest "dodatnim elektronem", czyli
antycząstką dla elektronu. Gdy na swej drodze napotka elektron, znajdujący się na orbicie dowolnego atomu, wówczas dochodzi do anihilacji obu cząstek, czyli całkowitego przekształcenia ich w energię, zgodnie z
zasadą równoważności masy i energii, sformułowaną przez Einsteina. Podczas anihilacji powstają dwa kwanty
promieniowania gamma o energii odpowiadającej masie spoczynkowej każdej z cząstek, czyli 511 keV każdy. Rozchodzą się one zawsze pod kątem 180 stopni:
 |
By Jens Maus (http://jens-maus.de/) - own work - part of PhD thesishttp://nbn-resolving.de/urn:nbn:de:bsz:14-qucosa-23509, Public Domain, https://commons.wikimedia.org/w/index.php?curid=379922
|
Właśnie tę właściwość kwantów powstałych w wyniku anihilacji pary elektron-pozyton wykorzystuje pozytonowa tomografia emisyjna. Ponieważ podczas anihilacji oba kwanty powstają jednocześnie i rozchodzą się w ściśle przeciwległych kierunkach, istnieje możliwość precyzyjnego zlokalizowania ich źródła, a także odróżnienie kwantów pochodzących z anihilacji od promieniowania z innych źródeł. Pozostaje tylko kwestia dostarczenia izotopu do organizmu pacjenta i sprawienia, by przedostał się do tkanki, którą chcemy badać.
Izotopy podawane są najczęściej w postaci substancji biorących udział w przemianach metabolicznych w organizmie, w których jeden z atomów jest "podmieniony" na izotop ulegający przemianie beta plus. Najczęściej jest to
fludeoksyglukoza, czyli pochodna
glukozy, w której jedna z grup hydroksylowych (-OH) zastąpiona jest przez atom fluoru.

Jeżeli w takiej cząsteczce naturalny, niepromieniotwórczy fluor-19 zastąpimy radioaktywnym fluorem-18, otrzymamy wówczas radiofarmaceutyk znany pod nazwą
18-F-FDG, pozwalający na dostarczenie fluoru-18 do wszystkich komórek organizmu. Glukoza, będąca głównym "paliwem" dla wszystkich tkanek organizmu, jest również absorbowana przez komórki nowotworowe. Ponieważ jednak metabolizm komórek nowotworowych odbywa się głównie na mniej wydajnej drodze beztlenowej (tzw.
zjawisko Warburga), powoduje to wyższe zapotrzebowanie na glukozę niż komórek zdrowych, a tym samym większą koncentrację fluoru-18 "podczepionego" do glukozy. Pozwala to wykryć nawet bardzo małe zmiany nowotworowe, będące w stadium umożliwiającym skuteczne i szybkie wyleczenie. Czas półrozpadu fluoru-18 wynosi zaledwie 109 minut, a produktem rozpadu jest stabilny tlen-18.
W technice PET stosowane są też inne radiofarmaceutyki, różniące się zarówno farmaceutykiem (nośnikiem izotopu, np. cholina, woda, amoniak), jak również samym izotopem (węgiel-11, tlen-15, azot-13). Przykładowo, w przypadku wody "podmieniany" jest naturalny tlen-16 na radioaktywny tlen-15. Wybór radiofarmaceutyku zależy od specyfiki badanego schorzenia i funkcji danego narządu.
Promieniowanie powstałe w wyniku anihilacji par pozyton-elektron wykrywane jest za pomocą zestawu kilku tysięcy detektorów scyntylacyjnych, ułożonych w formie pierścienia otaczającego pacjenta.
Działają one na zasadzie powstawania błysków światła (scyntylacji), w niektórych substancjach, zwanych scyntylatorami. Te błyski są następnie wzmacnianie przez fotopowielacz i kierowane do układów zliczających oraz analizujących. Szczególną rolę odgrywa tu układ koincydencyjny, który powoduje zliczanie tylko tych impulsów, które pojawiły się w tej samej chwili w leżących naprzeciw siebie detektorach. Pozwala to na rejestrowanie tylko tego promieniowania, które powstało w organizmie pacjenta w wyniku działania radiofarmaceutyku, a pomija promieniowanie pochodzące od naturalnych izotopów w organizmie człowieka (
potas-40), a także od tła naturalnego.
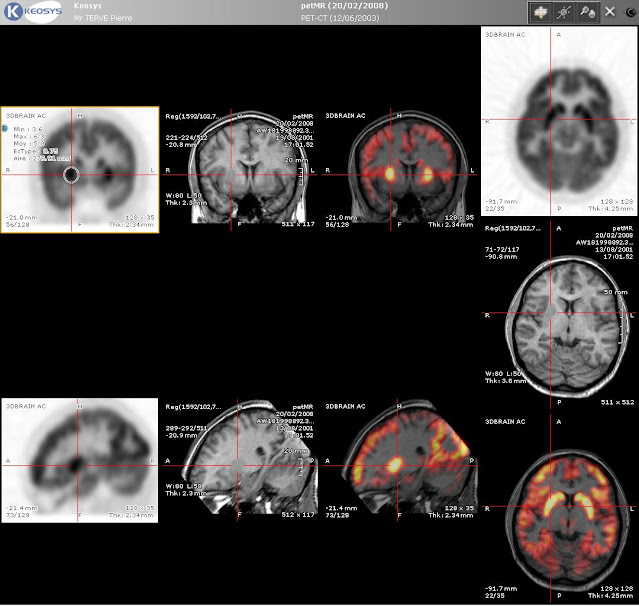
Ponieważ PET ukazuje przede wszystkim zmiany metaboliczne, bez wyraźnego obrazowania struktur anatomicznych, metoda ta jest łączona albo z rezonansem magnetycznym (PET-MRI), albo z tomografią komputerową (PET-CT). Poniżej widzimy porównanie obrazu uzyskanego metodą PET (z lewej), rezonansem magnetycznym (pośrodku) oraz w wyniku komputerowego nałożenia na siebie obu obrazów (z prawej):
Z kolei analogiczny obraz uzyskany z PET (dwa z lewej), tomografii komputerowej (szary) oraz połączenia obu tych metod (kolorowy), tym razem dla całego ciała, wygląda następująco:
Zaletą metody PET jest ograniczenie narażenia na promieniowanie jonizujące - przy zastosowaniu fluoru-18 (t1/2 = 109 min) izotop ulegnie całkowitemu rozpadowi po 10 okresach półrozpadu, a więc po 1090 minutach czyli 18 godzinach.
Jak sprawa wygląda od strony dozymetrycznej? Długo czekałem na możliwość dokonania pomiaru u osoby po badaniu PET, jednak przez dwa lata od opublikowania wpisu nikt się nie zgłosił, choć Czytelnicy pisali w różnych sprawach. Dopiero teraz (2023) koleżanka Żony zgodziła się wziąć dozymetr Radex Obsidian i dokonywać pomiarów od momentu pomiaru aż do wieczora tego samego dnia. Dozymetr ten loguje pomiar co 1 minutę i umożliwia eksport danych do komputera. Jak widać na poniższym wykresie, zmierzono spadek mocy dawki ze 130 µSv/h do 6,8 µSv/h w ciągu 10 godzin:
 |
Serdeczne podziękowania dla Pacjentki za przeprowadzenie pomiarów wypożyczonym przeze mnie dozymetrem!
|
W przypadku innych izotopów czas ten może być jeszcze krótszy np. rubid-82, występujący w preparacie Cardiogen-82 używanym przy badaniu przepływu krwi przez serce (PET perfusion imaging), ma czas półrozpadu 1,2 minuty. Jest on najkrótszy spośród izotopów najpowszechniej stosowanych w obrazowaniu PET:
- rubid-82 - ~1.27 min
- tlen-15 - ~2 min.,
- azot-13 - ~10 min.,
- węgiel-11 - 20 min.,
- gal-68 - ~67 min.,
- fluor-18 - 109 min.,
- cyrkon-89 - ~78.41 h,
Jest to jednocześnie wadą PET, ponieważ powoduje konieczność budowy cyklotronu produkującego izotopy bezpośrednio w miejscu prowadzenia badań, aby uniknąć nadmiernej utraty aktywności podczas transportu. Zwiększa to znacznie koszt badania i powoduje ograniczenie stosowania PET głównie do większych ośrodków medycznych. W Polsce badania metodą PET dostępne są w 16 ośrodkach na terenie 8 województw [
LINK]:
Pozytonowa tomografia emisyjna stosowana jest najczęściej do diagnostyki chłoniaków, nowotworów głowy i szyi, tarczycy i trzustki. Może służyć też do monitorowania postępów chemioterapii oraz diagnostyki padaczki. W przypadku niektórych nowotworów, np. jelita grubego, inne metody diagnostyczne są wystarczające, ale PET stosuje się np. do rozpoznawania przerzutów. Oczywiście w niektórych przypadkach PET będzie mieć mniejszą skuteczność, trudno jednak o uniwersalną technikę diagnostyczną w równym stopniu wykrywającą wszelkie zmiany.
***
Na koniec ostatnia kwestia, czyli bezpieczeństwo. Pozytonowa tomografia emisyjna przez swą istotę zakłada przyjęcie przez pacjenta pewnej dawki promieniowania jonizującego. Jest ona tak dobrana, aby zachowując skuteczność diagnostyczną jednocześnie ograniczyć możliwe negatywne konsekwencje, zgodnie z zasadą ALARA: As Low As Reasonably Achievable - tak mała (dawka), jak to realnie możliwe. Przyjęte dawki są rzędu kilku milisiwertów, czyli porównywalne lub nieco wyższe niż roczna dawka uzyskiwana przez mieszkańca Polski ze wszystkich źródeł, wynosząca 3,2-3,6 mSv. W przypadku metody PET-CT, w której obrazowanie odbywa się równocześnie poprzez pozytonową tomografie emisyjną, jak również "tradycyjną" tomografię komputerową (która wykorzystuje promieniowanie rentgenowskie) łączna dawka będzie sumą dawek od obu metod. Przykładowe rozkłady dawek możemy znaleźć w poniższej tabeli - jak widać, w zależności od badanego narządu lub części ciała większa dawka przypada bądź na PET, bądź na tomografię:
W przypadku metody PET-MRI, gdzie badanie PET połączone jest z rezonansem magnetycznym (MRI) dawka składa się wyłącznie z promieniowania pochodzącego od radiofarmaceutyku użytego w metodzie PET. Rezonans magnetyczny wykorzystuje pole magnetyczne, a nie promieniowanie jonizujące, więcej na ten temat pisałem w notce o promieniowaniu podczas badań diagnostycznych [
LINK].
Różnice w wielkości dawek przyjętych podczas PET wynikają też z rodzaju zastosowanego izotopu, jego aktywności w podanej dawce oraz czasu połowicznego rozpadu.
Z uwagi na obecność izotopu promieniotwórczego utrzymującą się przez kilka godzin w organizmie osoby badanej zalecane jest unikanie przez ten czas kontaktu z dziećmi i kobietami w ciąży. Zalecenie to wywodzi się z większej ich podatności na ewentualne negatywne skutki promieniowania. Z tego też powodu ciąża wyklucza możliwość przeprowadzenia badania. Wynika to ze wspomnianej wyżej zasady minimalizowania narażenia na promieniowanie jonizujące i ważenia stosunku zysków i strat.
W większości przypadków jednak dokładność metody PET, umożliwiającej wykrywanie nawet bardzo wczesnych zmian nowotworowych oraz innych zaburzeń funkcji organizmu powoduje, że zysk ze skutecznej diagnostyki znacznie góruje nad możliwymi negatywnymi skutkami promieniowania. Na tej samej zasadzie lepiej przyjąć małą dawkę promieniowania podczas prześwietlenia złamanej kończyny i mieć pewność właściwego nastawienia złamania niż ryzykować nieprawidłowe zrośnięcie się kości. Tym bardziej w przypadku nowotworów, gdzie gra toczy się często o najwyższą stawkę, a warunkiem powodzenia leczenia jest jak najwcześniejsza diagnoza. Nie bójmy się zatem PET, szczególnie że nie jest to metoda stosowana masowo i bez wyraźnej medycznej potrzeby nie otrzymamy skierowania na to badanie. Jeśli zaś już lekarz nas kieruje na PET, skorzystajmy z dobrodziejstw nauki i poddajmy się temu wyjątkowo dokładnemu badaniu.









Deoksyglukoza!
OdpowiedzUsuńPrzydatność PET mocno problematyczna, nawet na UM w Warszawie nie potrafią tego badania dobrze wykonać (przypadek rodzinny)